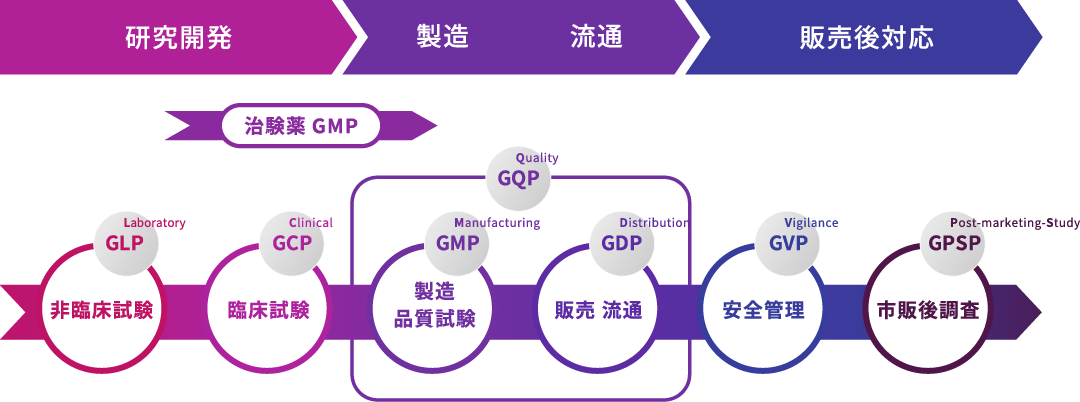
GxPにおける安全性・信頼性の確保
GxPへの取り組み
私たちは、医薬品の品質、有効性及び安全性の確保を第一優先とし、患者さん一人一人が安心して医薬品を使用できるよう、取り組んでいます。
ここではGxP※の観点から、各ステージにおける取り組みについて紹介します。
※GxP(Good x Practice)とは、政府等の公的機関で制定する基準の略称で、医薬品のライフサイクル(開発から販売終了まで)の各ステージにおいて、医薬品の安全性や信頼性を確保することを目的として制定されている。
- 非臨床試験(L:Laboratory)
- 臨床試験(C:Clinical)
- 製造(M:Manufacturing)
- 品質(Q:Quality)
- 流通(D:Distribution)
- 市販後安全管理(V:Vigilance)
- 市販後調査(PS:Post-marketing Study)
GLP
GLPは、非臨床安全性試験データの品質と信頼性を確保するために開発された品質管理及び品質保証のシステムです。
例えば、信頼性を備えた非臨床試験では、医薬品となる被験物質等の化合物に適用した設備、機器、組織及び試験の手順等を定めています。
また、「申請資料の信頼性の基準:医薬品医療機器法施行規則第43条」に準拠しGLP体制を明確化することで、試験方法、機器の使用や管理が適切であることを保証しています。加えて、高度な科学技術の観点から治験薬の有効性・安全性を調査・研究しています。
GCP
GCPに準拠した適切な臨床試験を実施するため、業務に関する標準手順書を定めています。加えて、私たちが大切にしている「患者さんに必要とされる医薬品を1日でも早く開発する」ために、一人ひとりの理解と意識を向上させる取り組みもしています。
例えば、疾患啓発活動や患者会に参加することを通して患者さんとご家族の生の声を聞き、その上でどのような臨床試験が望ましいのか、社内で常に忌憚のないディスカッションを重ねています。
また、疾患、患者さんの想い及び日常生活を理解するために、一例として児童発達支援士の資格をチーム全員が取得する等、患者さんに寄り添った開発を進めています。
治験薬GMP
治験薬GMPでは、均一な品質の治験薬を用いて治験の信頼性を確保し、治験薬の品質を保証することで被験者を安全に保護しています。
例えば、院内調剤で使用するシリンジやフィルター等について、薬剤の吸着による影響を確認する等、治験薬製造施設から出荷までをGCP部門と連携し適切に対応しています。
また、市販後においても医薬品の有効性と安全性を確保し、一刻も早く信頼性の高い医薬品を患者さんの手元へ届けるため、医薬品GMP製造部門と協力し、お互いの機器環境を揃える等の情報交換に取り組み、速やかに技術移管しています。
GMP
製造所では、GMP省令に則った業務をより高いレベルで実行するために、例えば、以下のような取り組みを行っています。
- PMDA※の発出するオレンジレターを題材にした事例研究:PMDAは定期的に、査察で観察された不備事項をオレンジレターとして配信しています。これらの事例を通じて現場で起きうる問題点を精査し、貴重な教訓を得るために議論しています。
- 風通しの良い職場づくり:工場長と従業員がともに昼食を取り、工場長が職場の意見を吸い上げる「ランチョン座談会」を開催したり、工場従業員が参加する定例会議で、各職場が取り組んでいるGMP活動を報告しています。
※PMDA:独立行政法人 医薬品医療機器総合機構(Pharmaceuticals and Medical Devices Agency)の略
研修会

工場長のランチョン

表彰式




GQP
当社は、市場に品質、有効性及び安全性を有する医薬品をお届けする医薬品製造販売業者としてGQPに規定されている医薬品の品質管理に関する基準を適切に遵守・運営しています。
主な業務
- 医薬品の市場への出荷の管理
- 製造業者等に対する管理監督
- 苦情(品質等に関する情報及び品質不良等)の処理
- 医薬品の回収が発生した場合の回収処理の指揮
GDP
現在、低温での保管管理が必要な医薬品については、温度制御装置付きの車両を使用して輸送しています。
輸送中の車両には温度をモニタリングするデータロガーを設置して、保管管理温度が維持されていることを確認しています。
中間製品の出荷

最終製品の出荷

GVP
GVPでは、治験及び市販後で認められた副作用情報を収集し、発現状況を評価検討し、医療関係者及び患者さんへ迅速に情報提供しています。
例えば、神経芽腫の治療薬のユニツキシンでは、収集した副作用情報を当社の製品サイトに掲載し、副作用に対する処置薬や処置方法に関する最新情報を医療関係者の皆様が確認できるようにしています。
加えて、医療関係者から薬剤の投与時の注意や副作用発現時の処置について問合せを受けた場合は、患者さんの安全を第一に考え、回答することを日々心がけています。
GPSP
GPSP省令は、製薬企業が実施する製造販売後調査等に関する業務が適正に実施され、また、再審査及び再評価の申請を行う際の資料の信頼性を確保するために、遵守すべき事項を規定した基準です。
現在、3品目の製造販売後調査を実施していますが、そのうち2品目は使用された全例のデータを収集しています。
それらの収集したデータは定期的に解析し、医薬品の使用状況や安全性及び有効性に影響を及ぼすと考えられる患者背景因子等の情報として、学会発表や論文化を行っています。そして学会発表や論文を通じて、治療ガイドラインの改訂根拠となるエビデンス創出を目指しています。